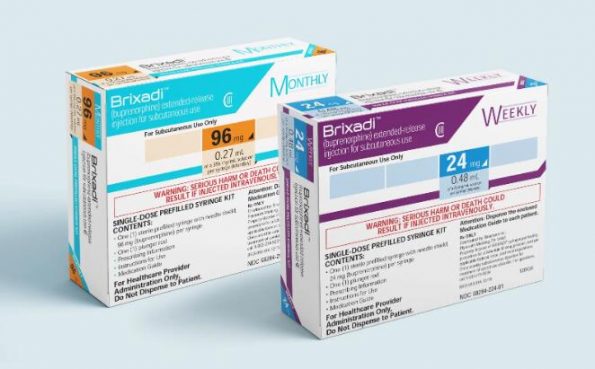
2023 年 5 月 23 日 – Braeburn 宣布美国食品和药物管理局 (FDA) 已批准 Brixadi(丁丙诺啡)皮下使用缓释注射剂 (CIII),这是一种新的每周一次和每月一次的药物,用于中度至已开始使用单剂量经粘膜丁丙诺啡产品治疗或已经接受含丁丙诺啡经粘膜产品治疗的患者的严重阿片类药物使用障碍 (OUD)。Brixadi 应作为包括咨询和社会心理支持在内的完整治疗计划的一部分。Brixadi 将仅由医疗保健提供者在医疗保健环境中进行管理,并将于 2023 年 9 月在美国上市。
Brixadi 是第一个也是唯一一个用于中度至重度 OUD 的每周和每月皮下注射剂,也是唯一一种使用 FluidCrystal®* Injection Depot Technology 的丁丙诺啡注射剂。根据 Brixadi 的处方信息,目前正在接受口服含丁丙诺啡产品治疗的患者可以转换为等效剂量的 Brixadi 每周或 Brixadi 每月。
“今天 FDA 批准 Brixadi 是对抗 OUD 的重要一步,”Braeburn 总裁兼首席执行官 Mike Derkacz 说。“在过去的三年里,美国经历了阿片类药物过量服用的显着增加,部分原因是经济和社会动荡对我们所有人产生了负面影响,尤其是患有阿片类药物使用障碍的人和正在康复的人。阿片类药物使用障碍的其他药物选择将支持医疗保健提供者满足其阿片类药物使用障碍患者的需求。”
由于意外静脉内 (IV) 给药可能造成严重伤害的风险,Brixadi 有一个黑框警告,并将通过名为 Brixadi 风险评估和缓解策略 (REMS) 的受限分发计划提供。订购和分发 Brixadi 的医疗机构和药房必须在此计划中获得认证并符合 REMS 要求。有关 Brixadi REMS 计划的信息将在 www.BrixadiREMS.com 上提供。
Brixadi 是唯一一种在为期 24 周的第 3 期双盲研究中针对舌下含服丁丙诺啡/纳洛酮 (SL BPN/NX) 研究的注射用丁丙诺啡,该研究将 428 名患有中度至重度 OUD 的成年人随机分组。该试验招募了代表现实世界人群的患者,包括注射阿片类药物的患者 (52%)、主要使用海洛因的患者 (71%)、有使用芬太尼证据的患者 (26%) 以及在筛选时使用非阿片类物质的患者( 71%)。在这项关键的 3 期疗效和安全性试验中,每周和每月 Brixadi 达到了非劣效性的主要终点,即反应率与每日 SL BPN / NX 相比(分别为 16.9% 和 14.0%;p <0.001)。此外,
“每周和每月注射一次不同剂量的丁丙诺啡可以符合临床实践和患者护理需求,”肯塔基大学药物和酒精研究中心行为科学和精神病学教授、该项目的主要研究员 Michelle Lofwall 博士说。 3 期疗效和安全性研究。“有些患者需要帮助才能按照处方服药,有些患者不喜欢每天服药或不去药房取药,因此每周和每月选择在一周或一个月内提供丁丙诺啡可以使患者受益,他们的亲人和治疗提供者。”
除了轻度至中度注射部位反应外,Brixadi 的安全性与已知的口服丁丙诺啡全身安全性一致。最常见的不良反应包括注射部位疼痛、头痛、便秘、恶心、注射部位红斑、注射部位瘙痒、失眠和尿路感染。
Brixadi 采用 FluidCrystal ® Injection Depot Technology 配制而成,可用于低容量预填充注射器。在注射并与组织中的液体接触后,该溶液会转变成纳米结构的液晶凝胶,从而可以在一周或一个月的时间内以稳定的速度缓慢释放丁丙诺啡。Brixadi 随附 23 号针头,可在臀部、大腿、胃(腹部)或上臂给药。** Brixadi 不需要冷藏。
关于Brixadi™
适应症和用法
Brixadi 适用于治疗已开始使用单剂量经粘膜丁丙诺啡产品治疗或已经接受丁丙诺啡治疗的患者的中度至重度阿片类药物使用障碍。
Brixadi 应作为包括咨询和社会心理支持在内的完整治疗计划的一部分。
重要安全信息
警告:静脉给药有严重伤害或死亡的风险;Brixadi 风险评估和缓解策略
- 如果静脉内给药,可能会导致严重伤害或死亡。Brixadi 与体液接触后形成液晶凝胶,如果静脉给药可能导致闭塞、局部组织损伤和血栓栓塞事件,包括危及生命的肺栓塞。
- 由于静脉内自我给药可能导致严重伤害或死亡的风险,Brixadi 只能通过名为 Brixadi REMS 的受限程序获得。订购和分发 Brixadi 的医疗机构和药房必须在此计划中获得认证并符合 REMS 要求。
Brixadi(丁丙诺啡)缓释注射剂(每周一次,50 mg/mL 丁丙诺啡)和 Brixadi(每月一次,356 mg/mL 丁丙诺啡)是不同的制剂。Brixadi 的剂量(每周一次)不能合并产生等效的每月剂量。
Brixadi 禁用于对丁丙诺啡或注射液中的任何其他成分过敏(如过敏性休克)的患者。
警告和注意事项
成瘾、滥用和误用:Brixadi 含有丁丙诺啡,这是一种附表 III 受控物质,可以以类似于其他阿片类药物的方式被滥用。监测所有患者的阿片类药物依赖和成瘾行为的进展。
呼吸和中枢神经系统抑制:丁丙诺啡与危及生命的呼吸抑制和死亡有关。对呼吸功能受损的患者慎用 Brixadi。由于其缓释特性,如果 Brixadi 由于呼吸功能受损而停药,监测患者持续的丁丙诺啡效应对 Brixadi(每周)约 1 个月和对 Brixadi(每月)约 4 个月。教育患者和护理人员如何识别呼吸抑制,并强调在已知或疑似用药过量时立即拨打 911 或获得紧急医疗帮助的重要性。
患者使用纳洛酮紧急治疗阿片类药物过量:与患者和护理人员讨论纳洛酮用于紧急治疗阿片类药物过量的可用性。由于正在接受阿片类药物使用障碍治疗的患者有复发的可能性,使他们面临阿片类药物过量的风险,因此强烈考虑在开始和重新使用 Brixadi 治疗时开出纳洛酮处方来紧急治疗阿片类药物过量。如果开了纳洛酮,就如何使用纳洛酮治疗患者和护理人员进行教育,并强调拨打 911 或获得紧急医疗帮助的重要性,即使使用了纳洛酮也是如此。
同时使用苯二氮卓类或其他中枢神经系统抑制剂:同时使用丁丙诺啡和苯二氮卓类或其他中枢神经系统抑制剂会增加不良反应的风险,包括呼吸抑制、用药过量和死亡。确保开出苯二氮卓类药物或其他中枢神经系统抑制剂处方的其他医疗保健提供者了解患者的丁丙诺啡治疗并协调护理以最大限度地降低伴随使用相关的风险。告知患者和护理人员,如果 Brixadi 与苯二氮卓类药物或其他中枢神经系统抑制剂,包括酒精一起使用,可能会发生潜在致命的附加效应,并且除非有医疗保健提供者的监督,否则不要同时使用这些药物。
新生儿阿片类药物戒断综合征、妊娠和哺乳期:新生儿阿片类药物戒断综合征 (NOWS) 是妊娠期间长期使用阿片类药物的预期和可治疗结果。医疗保健提供者应观察新生儿的 NOWS 迹象并进行相应管理。忠告妇女,如果她们在用 Brixadi 治疗时怀孕,婴儿出生时可能有戒断症状和戒断症状是可以治疗的。警告患者丁丙诺啡会进入母乳。建议哺乳母亲服用丁丙诺啡监测婴儿嗜睡和呼吸困难增加。
肾上腺功能不全:如果诊断出肾上腺功能不全,则通过生理性皮质类固醇替代疗法进行治疗,并让患者停用阿片类药物。
突然停药导致阿片类药物戒断的风险:选择停用 Brixadi 治疗的患者应监测戒断症状和体征,同时考虑到产品的缓释特性。
肝炎、肝脏事件和肝功能受损患者使用的风险:在开始前、治疗期间以及怀疑有肝脏事件时,应对所有患者进行肝功能测试。由于丁丙诺啡水平不能迅速降低,因此预先存在中度至重度肝功能损害的患者不适合使用 Brixadi 进行治疗。接受 Brixadi 治疗时发生中度至重度肝受损的患者应监测毒性或丁丙诺啡过量的体征和症状,并可能需要调整剂量。
超敏反应:在接受含丁丙诺啡产品的患者中,已有支气管痉挛、血管神经性水肿和过敏性休克病例的报道。Brixadi 针帽是从天然橡胶乳胶中合成提取的,可能会导致对乳胶敏感的个体产生过敏反应。
依赖全阿片受体激动剂的患者出现阿片类药物戒断: Brixadi 注射液可能导致身体依赖全阿片受体激动剂的个体出现阿片类药物戒断症状和体征。在新进入治疗的患者中,为避免促成阿片类药物戒断综合征,当出现轻度至中度戒断的客观体征时给予 4 mg 测试剂量的经粘膜丁丙诺啡,并在注射 Brixadi 前监测沉淀戒断。
突发急性疼痛的治疗:尽可能用非阿片类镇痛药治疗接受 Brixadi 的患者。需要阿片类药物镇痛的患者可以在医疗保健提供者的监督下接受高亲和力的全阿片类镇痛药治疗,特别注意呼吸功能。忠告患者指示他们的家庭成员的重要性,在紧急情况下,通知治疗卫生保健提供者或急诊室工作人员患者正在用 Brixadi 治疗。对于过去 6 个月内接受过 Brixadi 治疗的任何患者,也应考虑上述指导。
有心律失常风险的患者:对丁丙诺啡产品进行的全面 QT 研究表明 QT 延长 ≤ 15 毫秒。这种 QTc 延长效应似乎不是由 hERG 通道介导的。基于这两项发现,丁丙诺啡在没有危险因素的患者中单独使用时不太可能导致心律失常。丁丙诺啡与其他 QT 延长剂合用的风险尚不清楚。
驾驶和操作机械能力受损:警告患者不要驾驶或操作危险机械,直到他们合理确定 Brixadi 不会对他们从事此类活动的能力产生不利影响。
直立性低血压:丁丙诺啡可能会在卧床患者中产生直立性低血压。
脑脊液压力升高:丁丙诺啡可能会升高脑脊液压力,头部受伤、颅内病变和其他脑脊液压力可能升高的情况下应谨慎使用。
胆总管内压升高:丁丙诺啡已被证明会增加胆总管内压,其他阿片类药物也是如此,因此胆道功能障碍患者应谨慎使用。
对急性腹部疾病的影响:丁丙诺啡可能会掩盖急性腹部疾病患者的诊断或临床病程。
不良反应
通常与 Brixadi 给药相关的不良反应(在 ≥5% 的患者中)是注射部位疼痛、头痛、便秘、恶心、注射部位红斑、注射部位瘙痒、失眠和尿路感染。
关于布雷本
Braeburn 致力于为遭受阿片类药物使用障碍严重后果的人们提供解决方案。在 Braeburn,我们通过与社区合作帮助创造一个世界,让每个患有 OUD 的人都能得到最好的护理和充分发挥其潜力的机会,从而挑战阿片类药物使用障碍 (OUD) 管理的现状并倡导变革。访问 https://braeburrx.com 了解更多信息。在 LinkedIn 上与 Braeburn 联系,网址为 https://linkedin.com/company/Braeburn。
资料来源:Braeburn Inc.


