Sequana Medical NV 是治疗肝病、心力衰竭和癌症液体超负荷的先驱,宣布美国食品和药物管理局 (FDA) 已经批准了其第二代 DSR 产品的研究性新药 (IND) 申请( DSR 2.0) 用于治疗充血性心力衰竭。这使公司能够按计划于 2023 年第二季度在美国启动其随机对照阶段 1/2a MOJAVE 研究。
Sequana Medical 首席医疗官 Oliver Gödje 评论道:“我们很高兴我们的 DSR 2.0 产品获得 IND 批准,并准备及时在美国充血性心力衰竭患者中开展 MOJAVE 研究。我们现在专注于招募我们的第一位患者,我们预计这将在 2023 年第二季度进行,并期待在年底前报告非随机队列中三名患者的数据。”
Sequana Medical 首席执行官伊恩·克罗斯比 (Ian Crosbie) 补充说:“对于美国估计有 200,000 名利尿剂耐药的充血性心力衰竭患者,迫切需要能够安全有效地消除充血、减少重复住院并改善临床表现的新疗法。结果。根据我们的 RED DESERT 和 SAHARA 概念验证研究报告的强大安全性和有效性数据,我们相信我们的 DSR 疗法有可能成为一种改善疾病的心力衰竭疗法。”
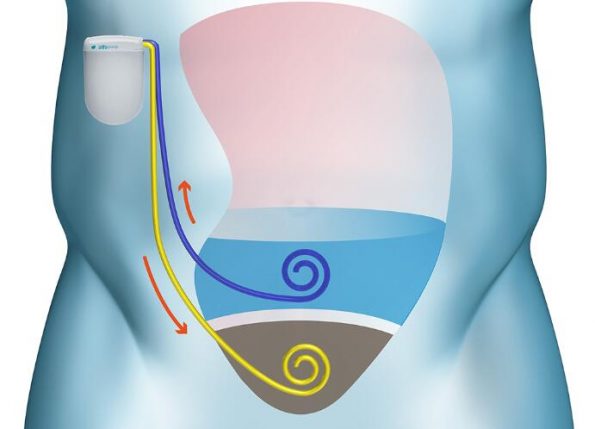
MOJAVE 是美国的一项随机对照 1/2a 期研究,旨在评估 DSR 2.0 在持续充血的利尿剂抵抗性慢性心力衰竭患者中的安全性和有效性。
经伦理委员会批准后,该研究将开始于一个非随机队列,该队列由三名接受 DSR 2.0 治疗的符合条件的患者组成,通过腹膜透析 (PD) 导管进行治疗,除了充血性心力衰竭的常规护理之外长达四个星期,然后是三个月的安全随访期。最多 30 名额外患者的随机队列的进展取决于数据和安全监测委员会 (DSMB) 在审查非随机队列数据后的批准。
随机队列包括最多 20 名接受 DSR 2.0 治疗的随机患者,通过 PD 导管给药,在充血性心力衰竭的常规护理之外长达 4 周,最多 10 名随机患者单独接受静脉袢利尿剂治疗,作为最大限度地对充血性心力衰竭进行常规护理。四个星期的治疗后,有三个月的安全随访期。
主要和次要安全性和有效性终点包括不良和严重不良事件的发生率以及从基线到治疗期结束时利尿剂反应(以六小时尿钠排出量衡量)的改善。从基线到治疗期结束测量的探索性终点包括体重变化(体积状态)、肌酐(肾功能标志物)、利钠肽(心力衰竭标志物)和纽约心脏协会(NYHA)功能等级;以及与心力衰竭相关的再住院治疗的数量。
Sequana Medical 认为其专有的 DSR 是一种治疗充血性心力衰竭的疾病改良疗法。心力衰竭患者的体液积聚是由过多的钠潴留引起的。基于 DSR 药物的方法直接解决了钠超载这一关键临床问题,并与肾脏合作,安全快速地消除多余的液体。作为对现有心力衰竭疗法的补充,使用公司第一代 DSR 产品 (DSR 1.0) 进行的临床概念验证研究表明,DSR 可以 i) 安全、有效和快速地消除心力衰竭患者的液体超负荷,ii) 改善心脏健康并保护肾功能,以及 iii) 恢复肾脏自然管理液体和钠的能力,导致对利尿药物的需求大幅度而持久地减少。在接受 DSR 治疗的患者中,在研究随访期间没有出现与充血相关的再住院,所有患者的 NYHA 状态至少提高了一个等级,临床研究中观察到的临床益处导致 75% 的减少基于西雅图心力衰竭模型预测强化 DSR 治疗前后患者的一年死亡率。
Sequana Medical NV 是治疗体液超载的先驱,体液超负荷是肝病、心力衰竭和癌症患者严重且常见的临床并发症。


